药物临床试验机构
一、医院简介
甘肃省妇幼保健院(甘肃省中心医院)始建于1942年,是一所集医疗、教学、科研、预防、保健、康复等功能为一体的省属综合性三级甲等医院、省直保健定点医院。在2021 年国家三级公立医院绩效考核中,位列全国84家三级妇产医院(含妇幼保健院)第10名,连续三年考核获评等级A;在全国首次妇幼保健机构绩效考核中,位居全国249家三级妇幼保健院第11位,获评最高A++等级,成为西北地区唯一入围第一梯队的妇幼保健院。
医院七里河院区(东院区)开放床位1500张。医院拥有国家级基地2个、国家级特色专科3个、省临床重点学科14个、省级质控中心6个、省级重点实验室1个、省级临床医学研究中心3个、省级急救中心3个.2022年医院门急诊量242.41万人次,出院病人数近8.62万人次,手术量2.68万余台,年分娩量21534例,妇科、产科、儿科及妇幼保健是全省优势学科。
甘肃省中心医院(安宁院区,西院区)2022年5月投入运行,编制床位3000张。医院以“大综合、强专科”为学科定位,对标国际化一流医疗服务平台、高端医学科研与转化平台、高层次国际学术交流与教育平台,强势发展肿瘤综合诊治、心脑血管、微创外科、器官移植、疑难危重症及医疗康复等,与国内外一流医疗及科研机构合力探索共建国际化、航空港式医学服务。2022年,门诊量已达40.59万人次,出院患者3.1万人次。
医院每年近250万门诊量,近9万住院患者量,诸多专业如足量获得合作方的认可。
二、临床试验机构简介
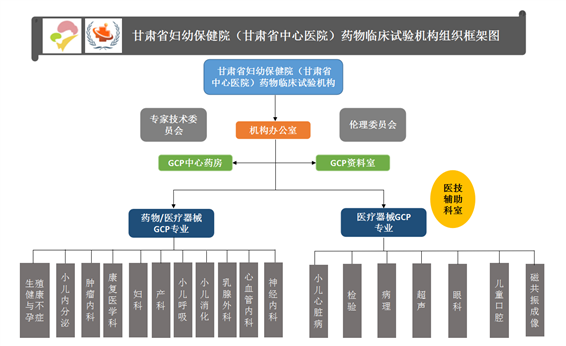
甘肃省妇幼保健院(甘肃省中心医院)临床试验机构于2018年7月成立,2019年8月获得国家药物临床试验机构认证资格(备案号:药临床机构备字2020000667)并同期完成国家医疗器械机构与专业备案(备案号:械临机构备201900109)。截止目前,具有药物/器械临床试验资格专业有11个,分别为:妇科、产科、生殖健康与不孕症、乳腺外科、小儿呼吸、小儿消化、小儿内分泌、神经内科、肿瘤内科、心血管内科、康复医学科。具有器械临床试验资格专业有7个,分别为:检验、小儿心脏病、磁共振成像诊断、超声诊断、病理、儿童口腔、眼科。各专业均制定了相应的管理制度和标准操作规程,设有专科病房、专科门诊及试验所需的配套设备,以及处理严重不良事件所需的急救药品和配套设备。机构内部质量体系完善,历经多次上级部门检查,均顺利通过,能够确保临床试验项目的顺利实施。
我机构承接开展项目:II-IV期药物临床试验、医疗器械临床试验、体外诊断试剂临床试验。立项随到随审,接受伦理前置,立项可与合同、人遗等同步,一般项目0.5-2月之内可启动。联系方式如下:
办公电话(传真):0931-5188689;
办公地址:甘肃省妇幼保健院(甘肃省中心医院)七里河院区住院部16楼GCP机构办公室(730050)
机构邮箱:GSFYGCP@163.com
三、机构办事流程
1、甘肃省妇幼保健院(甘肃省中心医院)临床试验申办方及第三方告知书
——运转流程相关
临床试验申办方及第三方:
您好!很高兴与您成为合作伙伴。为确保贵公司临床试验项目的顺利实施,机构办公室将依据本中心临床试验项目的运行管理流程,对各个环节需要注意的事项向您告知。
■新项目接洽及审查
①本机构对于新项目需要进行意向审查(非注册项目除外)和受理审查;
②意向审查前,请按要求提交电子材料至机构办公室邮箱GSFYGCP@163.com;
③意向审查通过且确认PI后进入受理审查。请按照临床试验项目文件递交清单及立项申请表等完整的纸质文件至机构办公室,要求黑色 A4 快劳夹装订,文件夹侧面和封面请标注项目名称、申办者等信息,文件内容应有目录、索引;
④进入受理审查程序的5-10工作日内机构办公室将给与立项回复;
⑤本中心开展的临床试验项目原个则上要求申办者为项目研究团队配备专职 CRC。该岗位人员如由SMO公司提供,申办者/CRO应在受理审查阶段与机构共同优选确定;
⑥受理审查通过后,机构办公室将告知受理审查结果及发放立项通知函;
⑦项目组凭立项通知函,按照伦理相关要求递交文件至伦理进行审查;
⑧请联系药品管理员以考查药房环境、沟通药品管理费以及管理细节等;
⑨建议在准备立项纸质材料时,可准备2份盖章版文件,备用于递交伦理材料和存放研究者文件夹中。
■获得伦理批件后的文件备案
①获得伦理批件后,请尽快将伦理审查批件扫描件发送至机构办公室邮箱GSFYGCP@163.com,并交纸质复印件至机构办公室;
②获得伦理批件后请将涉及的管理类样表(物资交接、药品管理、样本管理)及药品管理手册与机构质控管理员尽快当面沟通对接日后工作;
③临床试验项目试验方案签字及盖章要求:各承担临床试验的主要研究者(签名)、临床试验机构(签章)、统计学负责人签名及单位盖章、申请者盖章(封面章、骑缝章)。
④获得人类遗传资源管理办公室批准(如适用)
备注:备案/审批申请的办理流程请咨询机构办公室秘书。
■合同洽谈、审查及签署
①机构受理审查通过后,请按照本机构的合同撰写/审核要点要求拟定合同内容,同时根据方案做好预算,期间主动与PI有效沟通,务必提前做好各检查化验项目的费用核实。与主要研究者就合同内容和预算确定后,请递交电子版的合同至机构办公室邮箱(GSFYGCP@163.com)或微信联系机构办主任或秘书;
②合同的签署需在获得伦理委员会批件后。
■启动前准备
①对新获得药物临床试验批件的,申请人须在获批件后完成试验登记,并获取试验唯一登记号,同时邮件告知机构办公室;
②医疗器械及体外诊断试剂类项目请至申办者所在省级药品监督管理部门备案,将加盖申办者公章的备案回执复印件交至机构办公室;
③如项目是在专业组开展的,则于启动会召开前,请提前联系机构质控员进行启动会前后安排一次质控检查;
④原则上启动会召开前,首付款及相关物资应已到位;
⑤试验用药品管理需要注意:若有新批次的试验用药品递送至本中心,应提前邮件和电话告知药品管理员。一旦申办者没有任何告知而直接将试验用药品送至药房,药品管理员将拒收。
■启动会召开
①与主要研究者确认启动会召开时间和地点,并通知到以下人员:机构办公室、伦理委员会、项目团队成员(包括CRC),涉及的辅助科室相关工作人员(检验科、病理科、药学部等)、专业组质控员。如无特殊情况,项目团队成员均应出席,其他部门应派代表出席,如药品涉及静脉配置要求,项目启动前CRA也要提前和我院静配中心护士长进行沟通。
②启动会需要进行临床试验方案培训、临床试验相关电子操作系统培训、试验用药品或其他涉及的试验用产品管理的培训、GCP相关培训;团队成员职责培训、需要进行分工授权签字确认(如涉及)等。
■受试者筛选入组及临床试验项目运行管理
①临床试验开展早期(第一例受试者入组后)、试验进行中期(约1/2病例入组)、试验完成后的项目进展信息,项目组应及时告知机构质控员及专业组质控员,以便后者进行质控安排;
②临床试验项目进展过程中的方案重大变更、重要的安全性事件等,请及时电话和邮件告知机构办公室。
③每次监查后,在将监查结果/随访函发给主要研究者的同时,CRA应将监查结果及情况反馈面告机构办。
■CRA及CRC变更
①试验实施过程中更换CRA/CRC,请至少提前15个工作日告知机构办公室;
②新任CRA应于上岗前与离任CRA/CRC充分交接,并在前任CRA/CRC离岗之日起及时到岗工作;
③新任CRA/CRC的备案要求同前;
■分中心小结盖章和结题
①最后一例受试者出组或数据库锁定前,项目组应按照《药物临床试验数据现场核查要点》或《医疗器械临床试验现场检查要点》要求适时进行自查,并提交自查报告;
②收到自查报告后,机构将启动锁库前质控检查,并出具质控报告;同时完成财务结算、资料归档,提交相关人员签字的信息确认表格;
③主要研究者适时提交分中心小结(如需要盖章),机构将进行审查。
④机构和伦理委员均审查通过后,予以盖章(如需要)。
临床试验相关样表及其他相关问题请致电(0931-5188689)及机构办主任(13893210796)或秘书(13893436438)咨询。
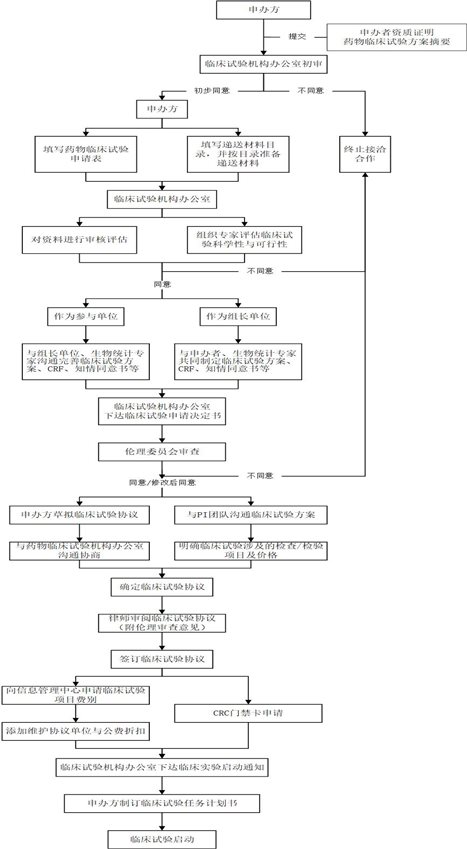
2、药物/医疗器械临床试验项目准备阶段
“药物/器械临床试验筹备流程图”如下:
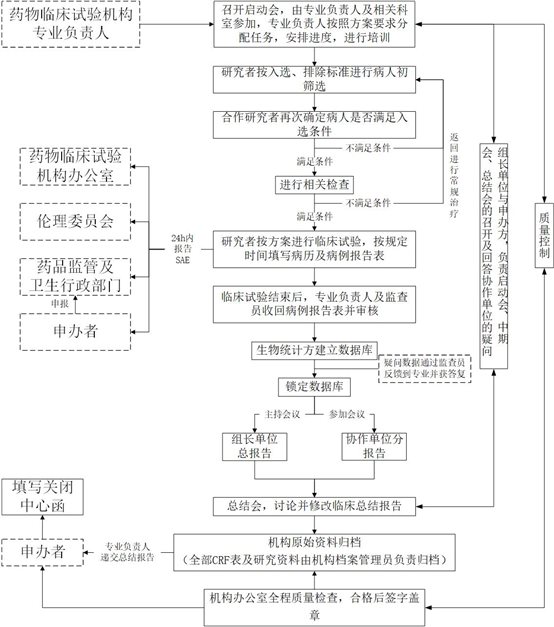
3、 药物/医疗器械临床试验项目实施阶段
“药物/器械临床试验实施流程图”如下:
4、 药物/医疗器械临床试验结束阶段
4.1 项目结束后,按照试验用药物管理流程清点剩余药物/医疗器械,填写“临床试验用药品退还登记表”并退还申办者/CRO。
4.2 机构对试验项目进行结题前质量检查。
4.3 项目结束后,按照《药物/医疗器械临床试验结题档案目录清单》,研究者、研究助理及监查员将试验材料及时归档,交机构资料管理员保存。
4.4 用于申请药品注册的临床试验,必备文件应当至少保存至试验药物被批准上市后 5 年;未用于申请药品注册的临床试验,必备文件应当至少保存至临床试验终止后 5 年。医疗器械临床试验资料保存至临床试验结束后10年。后续资料保存事宜与申办方协商解决。
4.5 机构办公室向试验专业及其他相关科室下达“临床试验结束通知”。
4.6 若本单位为参与单位,PI 组织研究人员撰写《分中心小结》,若本单位为组长单位,PI 组织研究小组进行资料收集,召开总结会议并撰写《总结报告》。
4.7 申办者/CRO 向机构提交“关闭中心函”,附上“财务明细表”,并将《分中心小结》和《总结报告》(组长单位提供)各一份交至机构办公室,按 “药物/医疗器械临床试验结题签认表”要求,各方人员确认完成各项工作后签字,由机构办公室主任审议、签字、盖章。
5、相关下载
